Oxydation des métaux
Oxydation des métaux
I – Oxydation du fer
1) Les conditions de l’oxydation du fer
Expérience
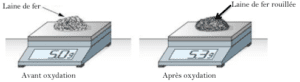
On place des clous en fer dans quatre tubes à essais. Quelques jours plus tard, on observe le résultat.
- Tube (1) : air sec
- Tube (2) : eau de robinet (eau + air)
- Tube (3) : eau salée
- Tube (4) : eau bouillie recouverte d’huile
Observation
- Le fer ne rouille ni dans l’air sec (1) ni dans l’eau bouillie (4).
- Le fer rouille dans l’air + eau (2).
- La quantité de rouille est plus importante dans l’eau salée (3).
Conclusion
- La rouille se produit lorsque le fer est exposé à la fois à l’eau et à l’aire (air humide).
- En présence d’air sec ou d’eau privée d’air (eau dégazée), le fer ne rouille pas.
- Le sel accélère la formation de la rouille.
2) Le rôle du dioxygène dans la formation de la rouille
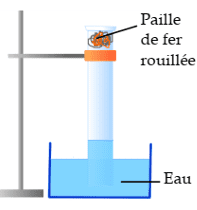
L’air est un mélange de gaz constitué majoritairement de diazote (N_{2} environ 80%) et de dioxygène (O_{2} environ 20%). Pour savoir quel gaz de l’air réagit avec du fer, on peur réaliser l’expérience schématisée ci-dessous :
Expérience
Observation et interprétation
- Le volume d’air contenu dans l’éprouvette a diminué de 20%. Cela signifie que le dioxygène est le gaz avec le fer pour former la rouille, appelée oxyde de fer III.
- On peut exprimer cette réaction par son équation :
fer + dioxygène → oxyde de fer III - Cette réaction est appelée une oxydation.
Conclusion
- La transformation du fer en rouille est une réaction chimique lente entre le fer (Fe) en présence d’eau.
- La rouille est le produit de corrosion ou d’oxydation du fer. Elle est constituée essentiellement d’oxyde de fer III (oxyde ferrique), de formule chimique Fe_{2}O_{3}.
- L’équation bilan de cette réaction s’écrit :
4 Fe + 3 O_{2} → 2 Fe_{2}O_{3}
Remarque
- La rouille est une matière poreuse (perméable) qui favorise l’oxydation du fer en profondeur jusqu’à sa disparition totale. Ce phénomène est appelé la corrosion.
- Pour protéger le fer contre la rouille, on peut le recouvrir d’une couche imperméable (peinture – huile – zinc – chrome …) qui l’isole de l’air et de l’eau. On peut aussi mélanger le fer avec du carbone et du chrome pour obtenir un alliage plus résistant à la corrosion, appelé acier inoxydable (inox).
Application
II – Oxydation de l’aluminium
Expérience
On expose une plaque neuve en aluminium quelques jours à l’air humide.
Observation
L’aluminium perd son éclat métallique car il y a formation d’une couche terne (blanche) à son surface.
Cette couche est appelée oxyde d’aluminium ou alumine, de formule chimique Al_{2}O_{3}
Conclusion
- La formation de l’oxyde d’aluminium (alumine) est une réaction chimique lente entre l’aluminium est le dioxygène. c’est une oxydation dont l’équation bilan est :
4 Al + 3 O_{2} → 2 Al_{2}O_{3}
Remarque
L’alumine protège l’aluminium contre la corrosion profonde car elle forme une couche imperméable à l’air.