Les atomes et les ions
Les atomes et les ions
I – Structure de l’atome
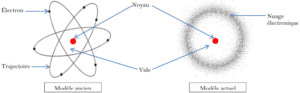
1) Modèles de l’atome
- Dans le modèle ancien, Bohr a suggéré que l’atome est constitué d’un noyau au centre, autour duquel les électrons tournent selon des trajectoires circulaires précises.
- Dans le modèle actuel, Schrödinger a montré que l’électron n’a pas de trajectoire précise, mais il décrit une zone où il y a une certaine probabilité de présence. Cette zone est appelée nuage électronique.
Application
représenter l’atome de Lithium selon le modèle de Bohr, sachant qu’il comporte 3 électrons.
2) Constituants de l’atome
a- Le noyau
- Le noyau est situé au centre de l’atome.
- Le noyau est situé au centre de l’atome.
- Le noyau contient presque toute la masse de l’atome.
- Le diamètre du noyau est 100 000 fois plus petit que le diamètre de l’atome.
- Le noyau porte une charge électrique positive (+), notée Q_{n}.
b- Les électrons
- Tous les électrons sont identiques quel que soit l’atome.
- Les électrons ont une masse très faible (négligeable).
- Entre les électrons et le noyau, il y a du vide.
- Chaque électron porte une seule charge négative (-).
- On symbolise l’électron par e^{-}
- La charge électrique d’un électron est -e, avec :
- e : charge élémentaire, c’est la plus petite quantité d’électricité.
e = 1,6 \times 10^{-19}C - C : le symbole de coulomb, unité internationale de la quantité d’électricité.
- e : charge élémentaire, c’est la plus petite quantité d’électricité.
C- La neutralité électrique de l’atome
- Chaque atome est caractérisé par son noyau et un nombre d’électrons, noté Z et appelé numéro atomique (Z est aussi le nombre de charges positives dans le noyau).
- L’atome est électriquement neutre (sa charge électrique est nulle) car la charge positive du noyau est opposée à la charge négative de l’ensemble des électrons.
- La charge des électrons est : Q_{e} = - Z.e
- La charge du noyau est : q_{n} = + Z.e
- La charge de l’atome Q_{a} = la charge des électrons + la charge du noyau
- Q_{a} = q_{n} + q_{e}
- Q_{a} = - Z.e + Z.e
- Q_{a} = 0C
Exemple
Application
- Calculer la charge électrique du noyau de l’atome de carbone en fonction de C.
- La charge électrique des électrons de l’atome d’aluminium est Q_{n} = -20,8 \times 10^{-19}C
Déduire Z, le numéro atomique de l’aluminium.
II – Les ions
1) Définition
- Un ion est un atome (ou un groupement d’atomes) qui a gagné ou perdu un ou plusieurs électrons.
- Un atome qui gagne des électrons devient un ion négatif appelé anion.
- Un atome qui perd des électrons devient un ion positif appelé cation.
- L’atome et l’ion qui en dérive sont caractérisés par la même valeur de Z (même noyau).
Remarque
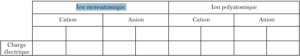
- Un ion qui dérive d’un seul atome est appelé ion monoatomique.
- Un ion qui dérive de plusieurs atomes liés est appelé ion polyatomique.
2) Formule d’un ion
On indique en haut et à droite du symbole de l’atome le nombre de charges élémentaires gagnées suivi de (-) ou perdues suivi de (+).
Exemples
Atome d’oxygène O : Z = 8
Atome d’aluminium Al : Z = 13
Application
Insérer chaque ion dans la case qui convient : Q_{3}O^{+} ; O^{2-} ; Al^{3+} ; NO_{3}^{2-} ; Cl^{-} ; Ca^{2+} ; NH_{4}^{+} ; CO_{3}^{2-}\\
Exercice 1
Une femme sur 4 et un homme sur 6 souffrent d’une carence en magnésium. Ce minéral est pourtant indispensable au
bon fonctionnement de l’organisme pour lutter contre le stress et la fatigue pour le bon fonctionnement des muscles…
Le magnésium est un métal qui existe dans le corps humain sous forme d’ions magnésium de formule chimique Mg^{2+} Cet ion possède 12 charges positives dans son noyau.
- Combien de charges positives contient le noyau de l’atome de magnésium ?
- Combien d’électrons l’atome de magnésium possède-t-il ?
- Quel est le nombre d’électrons de l’ion magnésium ?
- L’ion magnésium est-il un ion négatif (anion) ou un ion positif (cation) ?
Exercice 2
L’atome de fluor de symbole chimique F possède 9 charges positives dans son noyau.
- Combien d’électrons l’atome de fluor F possède-t-il ?
- Quel est le nombre de charges positives portées par le noyau de l’ion fluorure ?
- Sachant que l’atome de fluor de symbole F a gagné un électron pour devenir l’ion fluorure, quelle est la formule de l’ion fluorure?