Réaction de quelques métaux avec les solutions acides et basiques
Réaction de quelques métaux avec les solutions acides et basiques
I – Réaction entre l’acide chlorhydrique et les métaux
1) Activité expérimentale
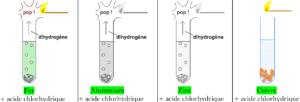
On verse de l’acide chlorhydrique (H^+ , Cl^-) dans quatre tubes à essais contenant respectivement du fer, de l’aluminium, du zinc et du cuivre tout en approchant une flamme de l’entrée de chaque tube.
Expérience
Observation et interprétation
- Pour le Fer, Aluminium et le Zinc :
- Effervescence et dégagement d’un gaz qui produit une détonation au contact avec la flamme : c’est le dihydrogène H_{2}.
- Disparition progressive du fer, de l’aluminium et du zinc indique que ces métaux se sont transformés succécivement en ions Fe^{2+}, Al^{3+}et Zn^{2+}.
- La solution contenant du fer devient verte ; cela est due aux ions de fer II Fe^{2+}.
- Transformation des métaux en ions métalliques et de l’ion d’hydrogène H^+
en dihydrogène H_{2} signifient qu’il y a une réaction chimique.
- Pour le Cuivre :
- Il ne se passe rien : le cuivre ne réagit pas avec l’acide chlorhydrique.
Conclusion
- L’acide chlorhydrique ne réagit pas avec le cuivre.
- L’acide chlorhydrique (H^+ , Cl^-) réagit avec le fer (Fe), l’aluminium (Al) et le zinc (Zn). Lors de cette réaction, les ions hydrogène H^+ de l’acide réagissent avec le métal pour donner le dihydrogène H_{2} et l’ion métallique.
2) Les équations des réactions chimiques
✓ Réaction entre le fer et l’acide chlorhydrique
- Bilan de la réaction : acide chlorhydrique + fer → dihydrogène + chlorure de fer II
- Équation de la réaction : 2 (H^+ + Cl^-) + Fe → H_{2} + (Fe^{2+} + 2 Cl^-)
Les ions chlorure Cℓ- ne réagissent pas: on dit qu’ils sont spectateurs et n’apparaissent pas dans l’équation simplifiée.
Équation simplifié : 2 H^+ + Fe → H_{2} + Fe^{2+}
✓ Réaction entre le Zinc et l’acide chlorhydrique
- Bilan de la réaction : acide chlorhydrique + Zinc → dihydrogène + chlorure de Zinc
- Équation de la réaction : 2 (H^+ + Cl^-) + Zn → H_{2} + (Zn^{2+} + 2 Cl^-)
Équation simplifié : 2 H^+ + Zn → H_{2} + Zn^{2+}
✓ Réaction entre l’aluminium et l’acide chlorhydrique
- Bilan de la réaction : acide chlorhydrique + aluminium → dihydrogène + chlorure d’aluminium
- Équation de la réaction : 6 (H^+ + Cl^-) + 2Al → 3H_{2} + 2(Al^{3+} + 3 Cl^-)
Équation simplifié : 6 H^+ + 2 Al → 3 H_{2} + 2 Al^{3+}
Remarque
- Lors de la réaction, les ions hydrogène H+ se transforment en dihydrogène et leur nombre diminue, donc la solution devient moins acide et son pH augmente.
- Le fer, le zinc et l’aluminium réagissent avec les acides. Pour cette raison, les emballages alimentaires qui en contiennent sont protégés par du vernis ou de la peinture.
- L’acide chlorhydrique ne réagit ni avec le plastique ni avec le verre.
II – Réaction entre hydroxyde sodium et les métaux
Expérience
On verse de l’hydroxyde de sodium (Na^+ , HO^-) dans quatre tubes à essais contenant respectivement du fer, de l’aluminium, du zinc et du cuivre tout en approchant une flamme de l’entrée de chaque tube.
Observation
- La solution d’hydroxyde de sodium ne réagit ni avec le fer ni avec le cuivre.
- La solution d’hydroxyde de sodium réagit avec l’aluminium et le zinc.
- La réaction chimique a lieu entre les ions hydroxyde HO^- et les atomes du métal (Zn ; Al), elle produit du dihydrogène H_{2}et une solution ionique.
- La soude ne réagit ni avec le plastique ni avec le verre.